Swietna obsługa, profesjonalna, szybkie załatwienie problemu z dostawą, który wynikł niezależnie od sprzedawcy. Robię tu zakupy regularnie. Polecam
Recenzja potwierdzona zamówieniem.
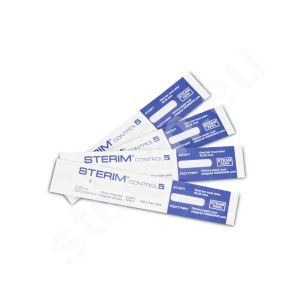
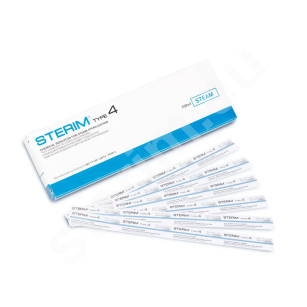
Rękaw płaski do sterylizacji
Rękawy do sterylizacji STERIM® składają się z części papierowej – wykonanej ze specjalnego papieru medycznego oraz z 8-warstwowego kompozytu poliestrowo-polipropylenowego CPPPT. Dzięki wyjątkowym cechom tych materiałów, 3-kanałowy zgrzew fabryczny jest trwały i elastyczny. Jednocześnie gwarantuje łatwe i bezpyłowe otwieranie opakowania.
Na linii zgrzewu rękawa do sterylizacji umieszczono wskaźniki chemiczne typu 1 sterylizacji STEAM, EO i FORM (wraz z informacją o kolorze wskaźnika przed i po procesie sterylizacji a także podstawowe informacje techniczne - nr LOT, data produkcji, rozmiar. Informacje podane są w czterech językach.
Po umieszczeniu umytych, zdezynfekowanych i wysuszonych narzędzi w rękawie oraz, opcjonalnie – zabezpieczeniu ostrych końcówek dla uniknięcia uszkodzenia opakowania, całość zamykana jest za pomocą zgrzewarki. Należy pamiętać też o umieszczaniu w pakiecie testu chemicznego typu 4,5 lub 6.
Temperatura zgrzewu wynosi 150-200°C i jest uzależniona od modelu zgrzewarki.
Zalety rękawów płaskich do sterylizacji STERIM®:
- wysoka jakość wykonania potwierdzona certyfikatem jakości ISO 9001:2015,
- możliwość pakowania instrumentów medycznych o różnych rozmiarach, kształtach, w tym porowatych,
- doskonała czytelność wskaźników sterylizacji, napisy informacyjne w języku polskim,
- wysoka jakość zgrzewu fabrycznego zapewnia szczelność mikrobiologiczną do 5 lat,
- dostępność różnych szerokości rękawów,
- rolki fabrycznie zabezpieczone specjalną folią termokurczliwą,
- posiadają etykiety, które pomagają przy identyfikacji produktu.
Dane techniczne:
- wyrób medyczny klasy 1, 93/42 EWG, znak CE, Zgłoszenie do Urzędu Rejestracji Wyrobów Medycznych,
- zgodność z normami: ISO 11607-1,2 : 2017; PN EN 868-5:2019; ISO 9001:2015,
- metody sterylizacji: parowa, formaldehydowa, tlenkiem etylenu.
Informacje o bezpieczeństwie produktu Informacje o producencie
Rękawy papierowo-foliowe do sterylizacji bez zakładki STERIM®
Rękawy do sterylizacji płaskie, papierowo-foliowe, pozwalają na sterylizację i przechowywanie materiałów porowatych, bielizny, obłożeń operacyjnych oraz płaskich narzędzi medycznych. Rękawy dostępne w wielu rozmiarach od 1 sztuki.
- Dodaj opinię: (Zobacz recenzje)
- Producent: Informer Med
 Duża
Duża
Reprezentujesz jednostkę budżetową?
Napisz do nas na info@sterim.eu i skorzystaj z odroczonej płatności!
EAN RSP050: 5904305484006, EAN RSP075: 5904305484037, EAN RSP100: 5904305484044, EAN RSP120: 5904305484051, EAN RSP150: 5904305484068, EAN RSP200: 5904305484075, EAN RSP250: 5904305484099, EAN RSP300: 5904305484105, EAN RSP350: 5904305484112, EAN RSP400: 5904305484273
Najczęściej kupowane z tym produktem
Sprawdź, co jeszcze kupują inni
Metkownica dwurzędowa do etykiet
Opinie
|
AG
|
Agnieszka G ponad pół roku temu
Swietna obsługa, profesjonalna, szybkie załatwienie problemu z dostawą, który wynikł niezależnie od sprzedawcy. Robię tu zakupy regularnie. Polecam |
|
KM
|
KATARZYNA MIKUTEL 04-12-2025
|
|
A
|
Anonim 10-09-2025
rękawy dostarczone w ekspresowym tempie, bardzo dobrze zabezpieczone. polecam |
|
A
|
Anonim ponad pół roku temu
Dobry zakup |
|
T
|
TomekT ponad pół roku temu
doskonała jakość i bezpieczne opakowane |
|
k
|
klient ponad pół roku temu
wszystko OK, |
Swietna obsługa, profesjonalna, szybkie załatwienie problemu z dostawą, który wynikł niezależnie od sprzedawcy. Robię tu zakupy regularnie. Polecam
Recenzja potwierdzona zamówieniem.
Zadaj pytanie dotyczące produktu. Nasz zespół z przyjemnością udzieli szczegółowej odpowiedzi na zapytanie.